原创 Mr lucky yang 如沐风科研 2021年03月03日 15:25【写在前面】:今天推荐的是由宁波第一医院联合宁波第九医院研究团队去年10月发表于Frontiers in Pharmacology(IF4.225)的一篇文章,揭示川芎嗪通过保护血脑屏障,减轻炎症和一氧化二氮系统改善大鼠脂多糖诱导的脓毒症。
【期刊简介】

图片源自Frontiers in Pharmacology官网杂志主页链接(网址https://www.frontiersin.org/journals/pharmacology)【接收范围及审稿周期】
出版包括基础和临床药理学,药物化学,药学和毒理学在内的各学科经过严格同行评审的研究,是该领域的领先期刊。
OA期刊,审稿周期一般为3~6个月。版面费基础研究为US$ 2,950(不同类型版面费不同)。
【题目及作者信息】
Tetramethylpyrazine AmelioratesLipopolysaccharide-Induced Sepsisin Rats via Protecting Blood–BrainBarrier, Impairing Inflflammation andNitrous Oxide Systems

【摘要部分】
本研究的目的是评价川穹的主要活性化合物—川芎嗪(TMP)对脂多糖(LPS)诱发败血症大鼠模型的血脑屏障,炎症和一氧化二氮系统的潜在影响(目的)。将SD大鼠分为对照组,LPS组和LPS+TMP治疗组。通过尾静脉注射给予TMP。在实验期间记录实验大鼠的死亡率。14天后处死大鼠,收集外周血并通过ELISA检测炎性因子TNF-α,IL-1β和IL-6的表达水平;通过荧光素钠染色检测血脑屏障的完整性;取肺和脑组织以检测免疫细胞的浸润;进行免疫组织化学检测紧密连接相关蛋白和氧化应激相关蛋白的表达(方法)。结果表明,TMP治疗14天可显著减少败血症大鼠的体重减轻并提高其存活率。TMP减少了炎症细胞的浸润并减轻了脓毒症对肺和脑组织的损害。在TMP治疗后,炎性细胞因子TNF-α,IL-1β和IL-6显著降低。荧光素钠染色密度的组织病理学分析表明,TMP对基底层和大脑皮层具有保护作用。此外,TMP显著增加了脑组织中紧密连接相关蛋白claudin-5和occludin的表达,并增加了ZO-1,Occludin和Claudin-5基因的表达,表明血脑屏障破坏的程度减轻了。此外,免疫组化(IHC)和免疫印迹证实TMP可以抑制一氧化二氮系统的指标iNOS和eNOS。此外,TMP显著降低了MDA和NO的水平(结果)。研究结果表明,败血症期间的TMP治疗与血脑屏障的保护以及炎性反应和一氧化二氮系统的抑制有关。这项研究揭示了TMP在败血症性脑病中的有希望的保护作用,并可能为在临床上对抗致命性败血症的疾病提供一种治疗方法(结论)。
(主要看原文表达,有助于我们自行撰写SCI)
【前 言】
川芎嗪(TMP)是中药川穹的主要活性成分,TMP目前用于治疗心脑血管疾病。研究证实,TMP通过调节氧化应激和缺血性缺氧对败血症具有抑制作用。伴随着自由基释放的全身性炎症反应通常被认为是个体败血症的潜在机制。这些自由基引起各种炎性细胞的浸润,刺激诸如肿瘤坏死因子和白介素的细胞因子的释放,并增强体内脂质的过氧化。研究表明,TMP可以有效去除氧自由基并减少组织损伤,血脑屏障通透性的变化与氧化损伤和血管舒张高度相关。因此,清除自由基和血管舒张可能对败血症的治疗至关重要。

前期研究表明,TMP可以抑制脂多糖(LPS)诱导的大鼠星形胶质细胞中的内皮型一氧化氮合酶,其机制与NOS有关。本研究旨在研究败血症大鼠模型中TMP对LPS诱导的败血症的影响,并探讨血脑屏障,炎症和一氧化二氮系统有关的潜在机制。
【结果部分】
1.LPS所致脓毒症大鼠体重变化及生存率。(A)对照组、LPS组和LPSTMP组14天大鼠体重变化趋势;(B)各组14天生存率。(C)LPS和LPS TMP组大鼠注射LPS后4h眼影的模拟和扩大。
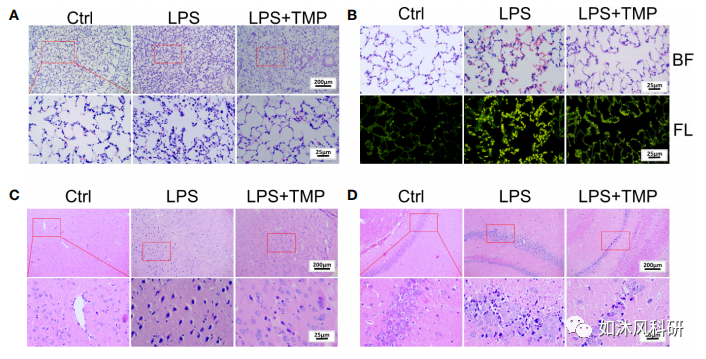
2.HE染色观察肺脑组织病理变化。(A)肺组织(上,100×;下,400×)。 (B)在荧光显微镜下观察肺组织(400×)。BF:光明场;FL:荧光。 (C)大脑皮层(上,100×;下,400×)。 (D)海马(上,100×;下,400×)
3. TMP对脓毒症大鼠血清炎性细胞因子和抗氧化酶的影响。(A)血清中炎性因子的表达水平。(B)大鼠肺灌洗液中炎性细胞因子的表达水平。(C)血清中抗氧化酶的表达水平。(D)肺组织中抗氧化酶的表达水平。与LPS组相比,** P <0.01。
4.TMP对LPS诱导的脓毒症血脑屏障破坏有保护作用。

(A)荧光素钠染色显示血脑屏障损伤程度,图像由紫外线凝胶成像仪拍摄。计算荧光素钠信号的相对强度。大鼠海马封堵器IHC染色(上,100×;下,400×)。(D)封堵器蛋白的相对IHC强度;(E)大鼠海马Claudin-5的IHC染色(上,100×;下,400×)。(F)Claudin-5蛋白的相对IHC强度;(G)大鼠海马Claudin-1的IHC染色(上100×;下400×)。克劳丁-1蛋白的相对IHC强度;(I)每组大脑中ZO-1、Occludin和Claudin-5基因的相对水平(n=8)。(J-K)Westernblot结果和直方图显示统计量化结果。与LPS组比较,*P<0.05,*P<0.01。与对照组相比,#P<0.05。
5.TMP对NOS、血清MDA和NO的影响。

(A)大鼠大脑皮层中eNOS的IHC染色(上部,100倍;下部,400倍)。(B)eNOS蛋白的相对IHC强度;(C)大鼠大脑皮层中的iNOS的IHC染色(上部,100倍;下部,400倍)。(D)iNOS蛋白的相对IHC强度;(E,F)对照组,LPS组和LPS + TMP组的血清MDA和NO含量(n = 8)。(G–J)Western blot检测大鼠大脑皮层中eNOS和iNOS的表达水平,直方图显示定量结果。与LPS组相比,* P <0.05,** P <0.01。
【结论与讨论】
研究表明,脓毒症期间产生过量的NO,脓毒症患者血浆中亚硝酸盐和硝酸盐的水平显著升高。脓毒症相关介质,如内毒素和促炎细胞因子IL-1b、IL-2、IL-6、TNF-a和IFN-b,已被证明能诱导iNOS的高表达。NO在LPS诱导的死亡中起着至关重要的作用。最近的研究表明,赖氨酸碱处理可以抑制LPS诱导的RAW264.7细胞诱导型一氧化氮合酶(iNOS)和环氧合酶2(COX-2)蛋白的上调。更多的证据已经证明,一氧化氮合酶(NOS)的上调对各种疾病的BBB有破坏性的影响。研究发现LPS组NO含量显著增加,相关蛋白如i,NOS和e,NOS的表达也显著增加。MDA含量的显著增加是脂质氧化损伤的一个指标,而鞘脂代谢的改变是LPS诱导的BBB破坏的一个潜在机制。因此,我们推测LPS对大脑BBB的破坏机制可能与一氧化氮合酶有关,而TMP可以通过抑制NOS的表达来保护血脑屏障,从而减少炎症反应。
目前,TMP已被开发用于通过注射治疗多种缺血性脑血管病(如脑供血不足和脑血栓形成。本研究发现TMP对脓毒症大鼠也有很好的保护作用。结果表明,TMP治疗可减轻体重减轻,提高生存率,减轻肺和脑组织损伤,降低TNF-a、IL-1b、IL-6、MDA和NO水平。此外,TMP还能保护板层和大脑皮层,增加紧密连接相关蛋白,抑制一氧化二氮系统指标iNOS和eNOS。 总之,TMP通过保护血脑屏障、抑制炎症反应和氧化亚氮系统,改善LPS诱导的大鼠脓毒症。本研究提出了一种治疗脓毒症致死性疾病的方法。
